Home | Polytechnic | Solve paper
UP Polytechnic Previous year paper Applied Chemistry 2024
Table of Contents
प्रश्न 1- संयोजकता का इलेक्ट्रॉनिक सिद्धान्त समझाइए।
Describe electronic theory of valency.
उत्तर- सर्वप्रथम सन् 1916 में कॉसेल तथा लुइस (Kossel and Lewis) ने इलेक्ट्रॉनों के पदों में रासायनिक आबन्धों के बनने की सफल व्याख्या की। इनका सिद्धान्त परमाणु के संयोजी कोश में उपस्थित इलेक्ट्रॉनों पर आधारित था, इसलिए इसे संयोजकता का इलेक्ट्रॉनिक सिद्धान्त (electronic theory of valency) भी कहते हैं। इस सिद्धान्त के अनुसार
1. किसी तत्त्व की संयोजन क्षमता उसके परमाणुओं के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या पर निर्भर करती है।
2. उत्कृष्ट गैसें (inert gases) निष्क्रिय होती हैं तथा वे बहुत कम तत्त्वों के साथ रासायनिक संयोग करती हैं। इनके इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं
| 2He | 1s2 |
| 10Ne | 1s2,2s2 2p6, |
| 18Ar | 1s2,2s2 2p6, 3s2 3p6 |
| 36kr | 1s2,2s2 2p6, 3s2 3p6 3d10, 4s2 4p6 |
| 54Xe | 1s2,2s2 2p6, 3s2 3p6 3d10, 4s2 4p6 4d10, 5s2 5p6 |
| 86Rn | 1s2,2s2 2p6, 3s2 3p6 3d10, 4s2 4p6 4d10 4f14, 5s2 5p6 5d10, 6s2 6p6 |
हीलियम जिसके बाह्यतम कोश में 2 इलेक्ट्रॉन हैं, को छोड़कर शेष सभी उत्कृष्ट गैसों के बाह्यतम कोश में 8 इलेक्ट्रॉन हैं, अत: इन गैसों की निष्क्रियता इनके बाह्यतम कोशों में उपस्थित 8 अथवा 2 (हीलियम के लिए) इलेक्ट्रॉनों के कारण है।
3. सभी परमाणुओं की प्रवृत्ति स्थायित्व प्राप्त करने की होती है, इसलिए सभी परमाणुओं की प्रवृत्ति निकटतम उत्कृष्ट गैस (अक्रिय गैस) इलेक्ट्रॉनिक विन्यास प्राप्त करने की होती है। दूसरे शब्दों में, सभी परमाणु दूसरे परमाणुओं से संयोजन करके अपने बाह्यतम कोश में 8 इलेक्ट्रॉन पूरे करके निकटतम उत्कृष्ट गैस का इलेक्ट्रॉनिक विन्यास प्राप्त करते हैं। इस नियम को अष्टक नियम (octet rule) कहते हैं।
हीलियम के पास के तत्त्व अपनी बाह्यतम कक्षा में 2 इलेक्ट्रॉन प्राप्त करने की प्रवृत्ति रखते हैं। इसे द्विक नियम (duplet rule) कहते हैं। 8 इलेक्ट्रॉनों वाले बाह्यतम कोश को अष्टक (octet) तथा 2 इलेक्ट्रॉनों वाले बाह्यतम कोश को द्विक (duplet) कहते हैं।
प्रश्न 2- हाइड्रोजन बन्ध की व्याख्या उदाहरण सहित कीजिए। (UP BTE 2003)
Explain hydrogen bond with the help of an example.
उत्तर- जब किसी हाइड्रोजनयुक्त यौगिक में हाइड्रोजन परमाणु एक अत्यधिक विद्युत ऋणात्मक परमाणु; जैसेफ्लोरीन, नाइट्रोजन या ऑक्सीजन के साथ संयुक्त होता है तो उच्च विद्युत ऋणता वाला परमाणु इलेक्ट्रॉन युग्म को अपनी ओर अधिक आकर्षित कर कुछ ऋणात्मक हो जाता है और हाइड्रोजन परमाणु कुछ धन आवेशित हो जाता है।
यह हाइड्रोजन जोकि प्रोटॉन की भाँति कार्य करता है, दूसरे अणु के उच्च विद्युत ऋणता वाले परमाणु की ओर आकर्षित हो जाता है। इस प्रकार एक हाइड्रोजन परमाणु उच्च विद्युत ऋणता वाले तत्त्व के दो परमाणुओं के बीच एक पुल (bridge) का कार्य करता है। यह हाइड्रोजन एक ऋणात्मक परमाणु के साथ तो सहसंयोजक बन्ध (covalent bond) बनाता है और दूसरे ऋणात्मक परमाणु के साथ एक दुर्बल स्थिर वैद्युत (electrostatic force) द्वारा सम्बद्ध होता है जिसे हाइड्रोजन बन्ध कहते हैं और इसे बिन्दुदार रेखा (dotted line) द्वारा प्रदर्शित करते हैं।
उदाहरणार्थ-हाइड्रोजन फ्लोराइड (HF), अमोनिया तथा जल के अणु द्रव या ठोस अवस्था में हाइड्रोजन बन्ध बनाते हैं।
प्रश्न 3– वैद्युत संयोजी तथा सहसंयोजी बन्धों को उदाहरण देकर समझाइए।
Explain electro valent and Co-valent bond with the help of example.
उत्तर– 1. वैद्युत संयोजी या आयनिक बन्ध इस बन्ध में इलेक्ट्रॉन का स्थानान्तरण (transfer) एक परमाणु से दूसरे परमाणु को हो जाता है और दोनों संयोजी परमाणु अपनी अष्टक पूर्ति कर आदर्श स्थायी रूप में परिणत हो जाते हैं। उदाहरणार्थ-सोडियम क्लोराइड, NaCl का बनना सोडियम की इलेक्ट्रॉनी अथवा इलेक्ट्रॉनिक व्यवस्था 2, 8, 1 होती है, जबकि क्लोरीन की 2, 8, 7 होती है।
सोडियम के अन्तिम कक्ष में एक इलेक्ट्रॉन तथा क्लोरीन के बाह्य कक्ष में सात इलेक्ट्रॉन होते हैं। सोडियम एक इलेक्ट्रॉन त्याग कर तथा क्लोरीन एक इलेक्ट्रॉन ग्रहण कर अष्टक (octet) पूरा कर सकता है। सोडियम के लिए सात इलेक्ट्रॉन ग्रहण करने की अपेक्षा एक इलेक्ट्रॉन त्याग करना आसान है, जबकि क्लोरीन के लिये सात इलेक्ट्रॉन त्याग करने की अपेक्षा एक इलेक्ट्रॉन ग्रहण करना आसान है।
अत: जब सोडियम तथा क्लोरीन परमाणु सम्पर्क में आते हैं तो सोडियम के बाह्य कक्ष का एक इलेक्ट्रॉन क्लोरीन के अन्तिम कक्ष में स्थानान्तरित (transfer) हो जाता है। इस प्रकार सोडियम तथा क्लोरीन दोनों परमाणु अपने अष्टक पूरा कर स्थायी अवस्था प्राप्त कर लेते हैं।
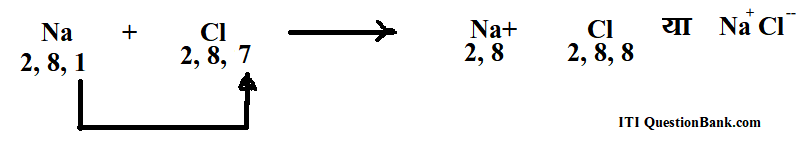
सोडियम का परमाणु एक इलेक्ट्रॉन त्याग कर विद्युत-धनात्मक आयन अर्थात् धनायन (cation) बन जाता है। क्लोरीन परमाणु एक इलेक्ट्रॉन ग्रहण कर विद्युत ऋणात्मक आयन अर्थात् ऋणायन (anion) बन जाता है।
Na – e– (इलेक्ट्रॉन) → Na + (सोडियम धनायन)
Cl+ e– → Ci– (क्लोराइड ऋणायन)
इन आयनों पर विपरीत आवेश (charge) होने के कारण इनमें स्थिर वैद्युत आकर्षण (electro-static attraction) रहता है। इस प्रकार बने यौगिकों को ध्रुवीय, आयनिक या वैद्युत संयोजी (polar or ionic or electrovalent) यौगिक कहते हैं।
2. सहसंयोजी बन्ध इस बन्ध में दो संयोजी परमाणु अपनी अष्टक पूर्ति के लिए इलेक्ट्रॉन की बराबर की साझेदारी (mutual sharing) करते हैं। साझे के इलेक्ट्रॉनों पर दोनों परमाणुओं का समान अधिकार होता है। उदाहरणार्थ-हाइड्रोजन अणु, H2 का बनना हाइड्रोजन परमाणु एक इलेक्ट्रॉन रखता है। इसे स्थायी अवस्था में आने के लिये एक अन्य इलेक्ट्रॉन की आवश्यकता होती है; क्योंकि हाइड्रोजन अपने एकमात्र कक्ष में अधिकतम दो इलेक्ट्रॉन रखकर अपना द्विक् अथवा ड्यूपलेट (duplet) पूरा कर लेता है। दोनों हाइड्रोजन परमाणु अपने ड्यूपलेट पूरा करने के लिये एक-एक इलेक्ट्रॉन की साझेदारी (सहभाजन) कर हाइड्रोजन अणु बनाते हैं।
H. + . H → H : H या H – H
इस प्रकार बने बन्ध को सहसंयोजी अथवा अधुवीय (covalent or non-polar) बन्ध कहते हैं। इस बन्ध द्वारा बने यौगिकों को सहसंयोजक यौगिक (covalent compounds) कहते हैं। इनका आयनन नहीं होता। अत: इन्हें अध्रुवीय (non-polar) यौगिक भी कहते हैं। सहसंयोजी बन्ध वैद्युत संयोजी बन्ध की अपेक्षा अधिक मजबूत होता है। हाइड्रोजन की सहसंयोजकता एक होती है।
प्रश्न 4- उपसहसंयोजी बन्ध को उदाहरण सहित समझाइए।
Explain co-ordinate bond with an example.
उत्तर- उपसहसंयोजी बन्ध यह बन्ध भी परमाणुओं के बीच इलेक्ट्रॉन युग्म की साझेदारी से बनता है, लेकिन इसमें इलेक्ट्रॉन युग्म केवल एक परमाणु द्वारा दिया जाता है। इलेक्ट्रॉन युग्म देने वाले परमाणु को दाता (donor) तथा युग्म ग्रहण करने वाले को ग्राही कहते हैं।
प्रश्न 5– सहसंयोजक आबन्धन के आण्विक कक्षक सिद्धान्त की संक्षेप में विवेचना कीजिए। यह संयोजकता बन्धन सिद्धान्त से किस प्रकार श्रेष्ठ है? एक उदाहरण द्वारा स्पष्ट कीजिए। (UP BTE 2009)
Explain molecular orbital theory of covalent orbit. How it is better from co-valent bond theory. Explain with an example.
अथवा
आण्विक कक्षक सिद्धान्त क्या है? (UP BTE 2015)
What is molecular orbital theory.
उत्तर- आण्विक कक्षक सिद्धान्त Molecular Orbital Theory इस सिद्धान्त के मुख्य बिन्दु निम्नलिखित हैं
(i) जब परमाणु मिलकर अणु बनाते हैं तो परमाण्वीय कक्षकों के परस्पर अतिव्यापन से नये कक्षक बनते हैं, जिन्हें आण्विक कक्षक कहते हैं।
(ii) आण्विक कक्षक वे ही परमाण्वीय कक्षक बनाते हैं जिनकी ऊर्जाएँ लगभग समान होती हैं और जिनका उचित विचक्रण (proper orientation) होता है। उदाहरणार्थ- 1s कक्षक 1s के साथ संयुक्त (अतिव्यापित) हो सकता है, 2s के साथ नहीं। Pz केवल साथ ही अतिव्यापन कर सकता है के Pa Px व Py के साथ नहीं।
(iii) बने हुए आण्विक कक्षकों की संख्या संयुक्त होने वाले परमाण्विक कक्षकों की संख्या के समान होती है।
(iv) दो परमाण्विक कक्षक मिलकर दो आण्विक कक्षक बनाते हैं जिनमें से एक बन्धित (bonding) आण्विक कक्षक और दूसरा प्रतिबन्धित आण्विक कक्षक (anti-bonding molecular orbital) होता है।
(v) बन्धित आण्विक कक्षक की ऊर्जा सम्बन्धित आण्विक कक्षक की ऊर्जा से कम होती है, फलत: बन्धित आण्विक कक्षक अधिक स्थायी होता है।
(vi) बन्धित आण्विक कक्षकों को तथा ग आदि चिह्नों द्वारा व्यक्त करते हैं, जबकि प्रतिबन्धित आण्विक कक्षकों को तथा 1* द्वारा व्यक्त करते हैं। *
(vii) आण्विक कक्षकों में इलेक्ट्रॉन ऑफबाऊ सिद्धान्त, पाउली के अपवर्जन सिद्धान्त तथा हुण्ड नियम के अनुसार भरे जाते हैं।
आण्विक कक्षक सिद्धान्त निम्न प्रकार संयोजकता बन्धन सिद्धान्त से श्रेष्ठ है
(i) संयोजकता बन्ध सिद्धान्त में अनुनाद (resonance) की धारणा मुख्य है, जबकि आण्विक बन्ध सिद्धान्त में अनुनाद की कोई भूमिका नहीं है।
(ii) संयोजकता बन्ध सिद्धान्त की सहायता से ऑक्सीजन का अनुचुम्बकीय (paramagnetic) स्वभाव नहीं समझाया जा सकता है, जबकि इसे आण्विक बन्ध सिद्धान्त की सहायता से समझाया जा सकता है।
(iii) संयोजकता बन्ध सिद्धान्त की सहायता से H2+ आयन का अस्तित्व नहीं समझाया जा सकता है, जबकि इसे आण्विक बन्ध सिद्धान्त की सहायता से समझाया जा सकता है।
(iv) MOT की सहायता से अणु में परमाणुओं के बीच आबन्ध कोटि (bond order) ज्ञात कर सकते हैं, जबकि VBT से यह ज्ञात नहीं किया जा सकता है।
प्रश्न 6- H2, O2, तथा N2 अणुओं का बनना अणुकक्षक सिद्धान्त के अनुसार कीजिए।
Express formation of H2,O2 and N2, molecule according to molecular orbital theory.
उत्तर 1. हाइड्रोजन अणु H2 अणु में केवल दो 1s कक्षक ही संयोग करते हैं। अत: इसका विन्यास [σ1s]2 होता है।
2. नाइट्रोजन अणु N (7) = 1s2, 2s2, 2p3, 2p1y, 2p1z.
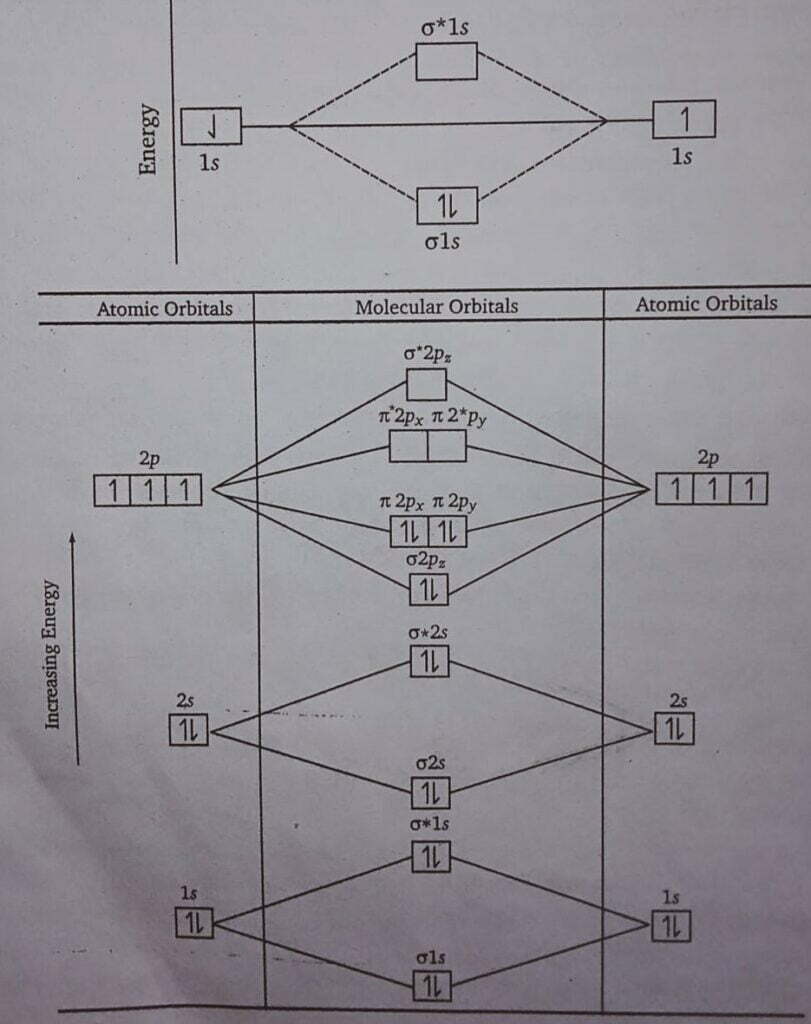
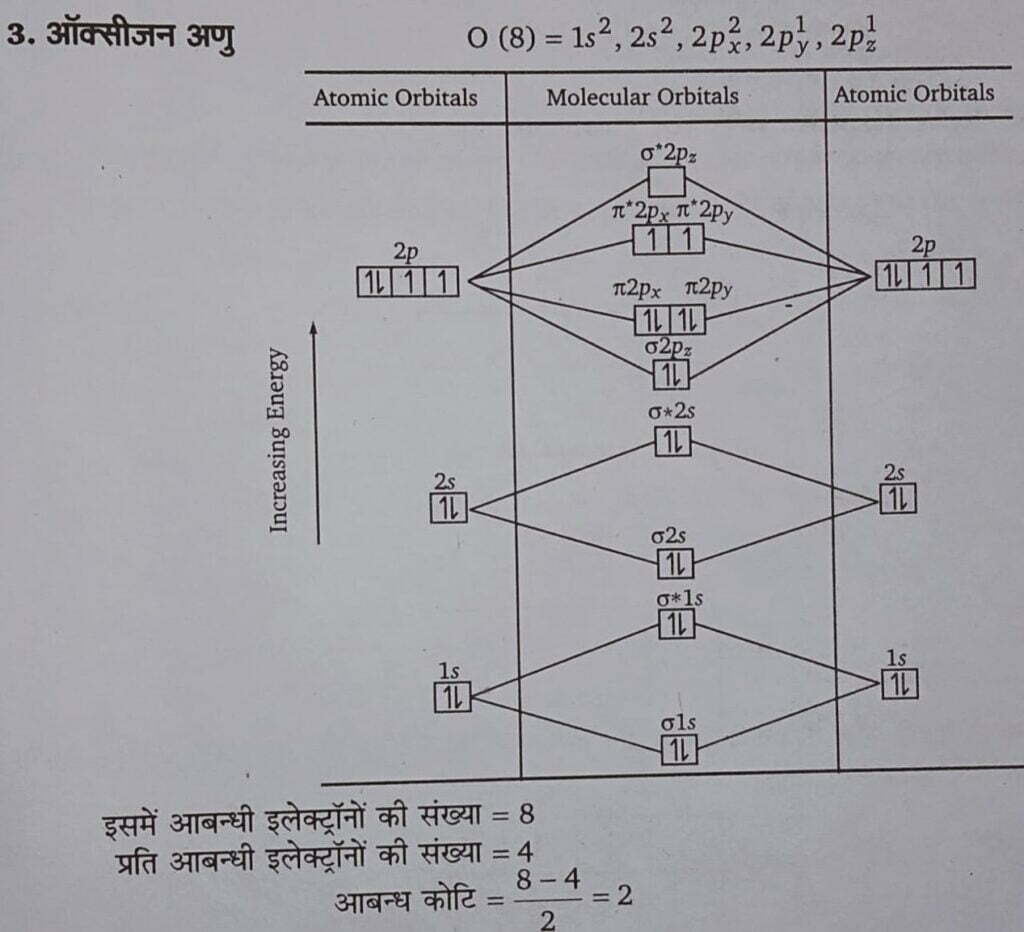
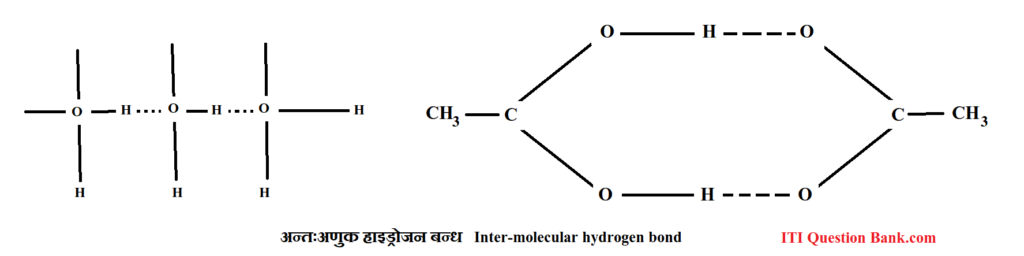
प्रश्न 7- उदाहरण देते हुए अन्तरा-अणुक तथा अन्तःअणुक हाइड्रोजन बन्ध में अन्तर बताइए। (UPBTE 2003)
Differentiate between inter-molecular H-bond and intra-molecular H-bond with the help of an example.
उत्तर- अन्तरा-अणुक तथा अन्तःअणुक हाइड्रोजन बन्ध में अन्तर Difference between Intermolecular H-Bond and Intramolecular H-Bond जब दो या अधिक अणुओं के बीच हाइड्रोजन परमाणु एक पुल की तरह कार्य करते हैं तो ऐसे हाइड्रोजन को अन्तरा-अणुक हाइड्रोजन बन्ध कहते हैं; जैसे-पानी, अमोनिया, ऐसीटिक अम्ल, हाइड्रोजन फ्लोराइड (HF) आदि, जबकि वे हाइड्रोजन बन्ध जो एक ही अणु के हाइड्रोजन तथा विद्युत ऋणात्मक परमाणुओं के अन्तर्गत बनते हैं, अन्तःअणुक हाइड्रोजन बन्ध (intra-molecular hydrogen bond) कहलाते हैं।
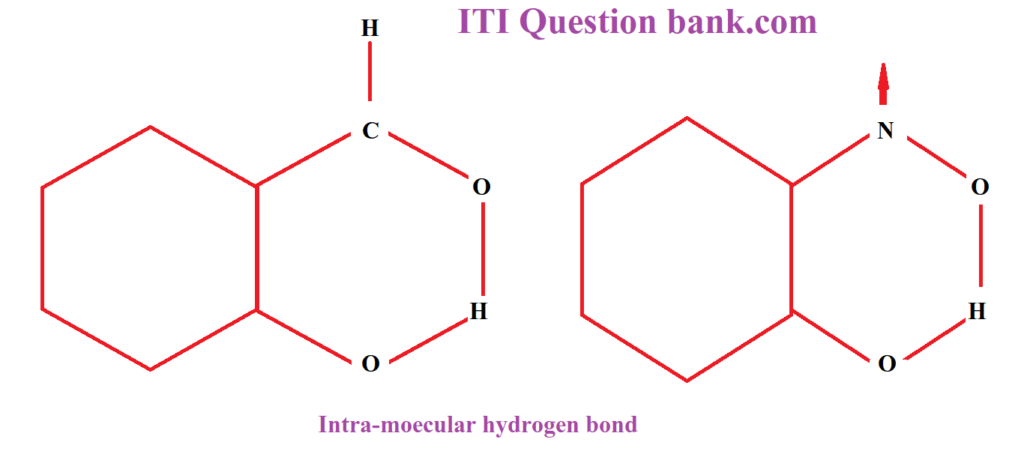
प्रश्न 8- संकरण को उदाहरण देकर समझाइए।
Describe hybridization with the example.
उत्तर- संकरण किसी परमाणु पर लगभग समान ऊर्जा वाले दो या अधिक परमाणु कक्षक जब परस्पर मिलकर एक ही आकार के समान संख्या तथा समान ऊर्जा के दो या अधिक नए कक्षक बनाते हैं तो यह प्रक्रिया संकरण कहलाती है।
उदाहरणार्थ – CH4 (मेथेन) आद्य अवस्था में, 6C → 1s2, 2s2,2p2
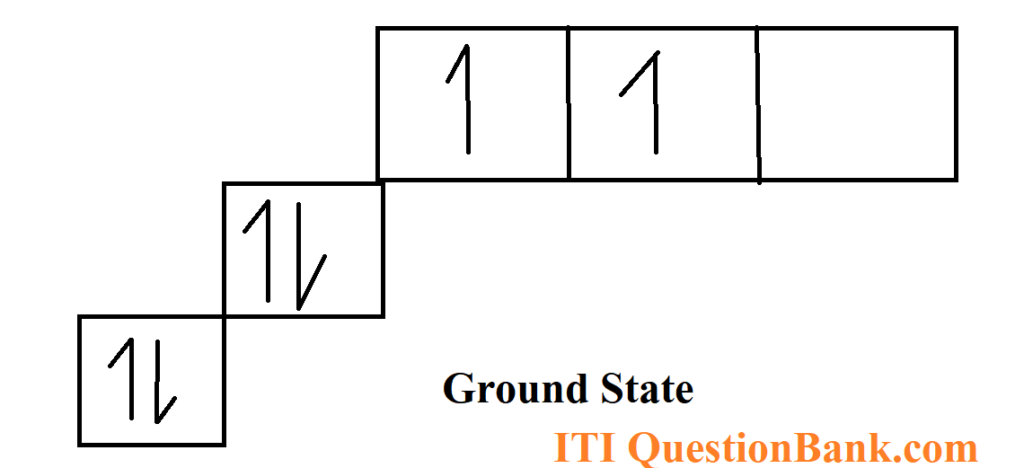
उत्तेजित अवस्था में, 6C → 1s2, 2s2,2p1x, 2p1y, 2p1z

कार्बन परमाणु के सबसे बाहरी कोश के S-कक्षक तथा तीन p-कक्षकों का संकरण होने के कारण समान ऊर्जा के चार संकर कक्षक बनते हैं।

प्रश्न 9- sp-संकरण को समझाइए।
Explain sp-hybridization
अथवा
ऐसीटिलीन में कौन-सा संकरण पाया जाता है? समझाइए।
Which type of hybridization is present in acetylene. Explain. (UP BTE 2015)
उत्तर- sp-संकरण sp-hybridization जब किसी परमाणु के बाहरी कोश पर एक s-कक्षक तथा एक p-कक्षक आपस में मिलकर समान ऊर्जा के दो नये कक्षक बनाते हैं तो इस प्रक्रम को sp-संकरण कहते हैं तथा इस प्रकार के संकरण से बनने वाले समान ऊर्जा वाले कक्षक sp-संकुरण कक्षक कहलाते हैं। sp-संकरण कक्षकों की व्यवस्था रेखीय (linear) होती है। इसमें 180° का कोण बनता है; जैसे—कार्बन परमाणु पर sp-संकरण निम्न प्रकार किया जा सकता है
6C → 1s2, 2s2,2p2 ( excited state)
6C → 1s2, 2s2,2p2
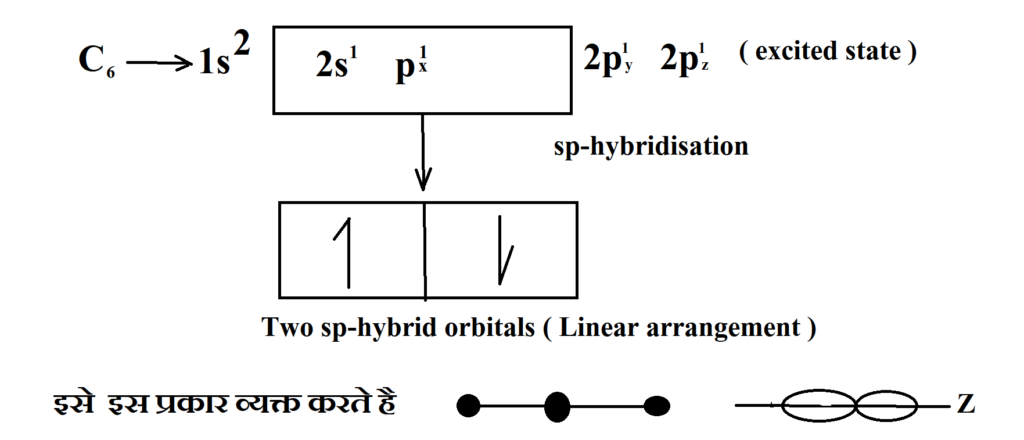
उदाहरणार्थ – CO2, C2H2 (acetylene), N2O, BeF2, BeCl2, NO2+ आदि अणुओं से sp-संकरण होता है। ऐसीटिलीन में कार्बन परमाणु के ऊपर sp-संकरण को निम्न प्रकार समझाया जा सकता है ऐसीटिलीन के निर्माण में एक 2s-कक्षक तथा एक 2p-कक्षक (2p1x) आपस में मिलते हैं तथा दो समान ऊर्जा के sp-संकर कक्षक बनाते हैं, फलस्वरूप नए बनने वाले संकरित कार्बन परमाणु का इलेक्ट्रॉनिक विन्यास 1s2,2[(sp)1, (sp)1, P1y, P1z.] हो जाता है।
दो sp-संकरित कक्षक 180° के कोण पर एक ही तल में रहते हैं।
अतः इस प्रकार के संकरण को विकर्ण संकरण (diagonal hybridisation) भी कहते हैं।
C2H2 में त्रिबन्ध (triple bond) के बनने में दो कार्बन परमाणु जिनमें से प्रत्येक के पास दो sp-संकरण होते हैं, एक 2p1y तथा दूसरा 2p1x कक्षक से निम्न प्रकार जुड़ते हैं
(a) प्रत्येक कार्बन परमाणु का sp-कक्षक सिरे के द्वारा अतिव्यापन करके दूसरे कार्बन परमाणु के sp-कक्षक के साथ जुड़कर सिग्मा बन्ध बनाता है।
(b) प्रत्येक कार्बन परमाणु का शेष बचा एक sp-कक्षक एक हाइड्रोजन परमाणु के 1s-कक्षक के साथ अतिव्यापन पर एक C-H सिग्मा बन्ध बनाता है।
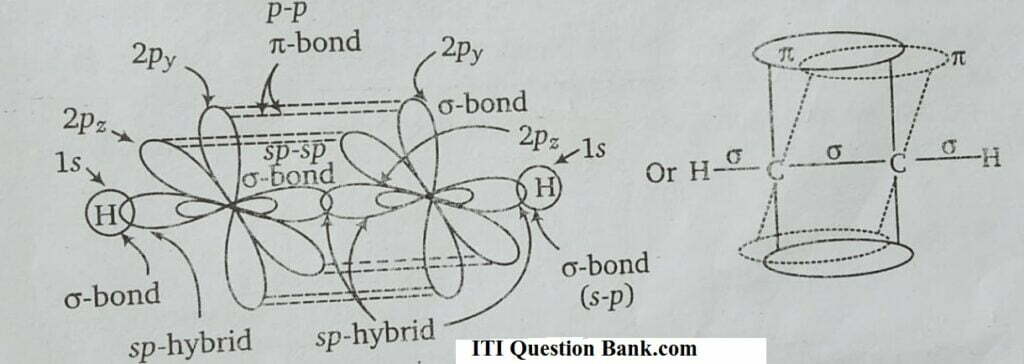
(c) प्रत्येक कार्बन परमाणु 2p1x तथा 2p1y कक्षक एक दिशा से (sidewise) अतिव्यापन करके दो T-बन्ध बनाते हैं। अत: ऐसीटिलीन में दो कार्बन परमाणुओं के बीच एक सिग्मा बन्ध तथा दो पाई बन्ध होते हैं।
प्रश्न 10- VSEPR सिद्धान्त की व्याख्या कीजिए।(UPBTE 2007,11)
Explain VSEPR theory principle.
अथवा
संयोजकता कोश इलेक्ट्रॉन युग्म विकर्षण सिद्धांत (VSEPR theory) का कथन लिखिए। (UPBTE 2014)
Write the statement of valence shell electron couple VSEPR theory.
उत्तर – लुइस अवधारणा अणुओं की आकृतियों की व्याख्या करने में असफल रही। सन् 1940 में सिजविक तथा पॉवेल (Sidgwick and Powel) ने सर्वप्रथम अणुओं की आकृतियों को समझाने के लिए एक सिद्धान्त दिया जिसे संयोजी कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धान्त (Valence Shell Electron Pair Repulsion Theory, VSEPR theory)
कहते हैं। इस सिद्धान्त को सन् 1957 में नाइहोम तथा गिलेस्पी (Nyholm and Gillespie) ने और अधिक विकसित तथा संशोधित किया। यह सिद्धान्त संयोजी कोश में उपस्थित इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण पर आधारित है। इस सिद्धान्त के अनुसार
1. अणु की आकृति केन्द्रीय परमाणु के आसपास स्थित संयोजी कोश में उपस्थित इलेक्ट्रॉन युग्मों (आबन्धित तथा अनाबन्धित) की संख्या पर निर्भर करती है।
2. केन्द्रीय परमाणु के संयोजी कोश में उपस्थित इलेक्ट्रॉन युग्म एक-दूसरे को प्रतिकर्षित करते हैं; क्योंकि उनके इलेक्ट्रॉन अभ्र पर ऋणात्मक आवेश होता है।
3. केन्द्रीय परमाणु के आसपास स्थित इलेक्ट्रॉन युग्म एक-दूसरे को प्रतिकर्षित करके ऐसी स्थिति में रखने की प्रवृत्ति रखते हैं जहाँ उनके मध्य प्रतिकर्षण बल न्यूनतम हो। न्यूनतम ऊर्जा वाला निकाय सर्वाधिक स्थायी होता है।
4. प्रतिकर्षण के फलस्वरूप इलेक्ट्रॉन युग्म केन्द्रीय परमाणु के चारों ओर निश्चित स्थान ग्रहण कर लेते हैं, इसलिए प्रत्येक अणु की निश्चित आकृति या ज्यामिति होती है।
5. यदि केन्द्रीय परमाणु के आसपास उपस्थित इलेक्ट्रॉन युग्म आबन्धी युग्म (bond pair) होते हैं तो वे समान प्रतिकर्षण बल लगाते हैं जिसके कारण अणु की आकृति सममित (symmetrical) होती है। ऐसे अणु की ज्यामिति को नियमित (regular geometry) कहा जाता है।
6. यदि केन्द्रीय परमाणु के आसपास आबन्धी इलेक्ट्रॉन युग्म और एकाकी युग्म दोनों होते हैं तो वे असमान प्रतिकर्षण बल लगाते हैं जिसके कारण अणु की आकृति असममित (asymmetrical) होती है। ऐसे अणु की ज्यामिति को अनियमित अथवा विकृत ज्यामिति (irregular or distorted geometry) कहते हैं। (नाइहोम तथा गिलेस्पी का संशोधन)।
इलेक्ट्रॉन युग्मों के मध्य प्रतिकर्षण का क्रम इस प्रकार होता है
एकाकी युग्म-एकाकी युग्म > एकाकी युग्म-आबन्धी युग्म > आबन्धी युग्म-आबन्धी युग्म
प्रश्न 11- VSEPR सिद्धान्त के अनुसार अमोनिया व जल के अणुओं की संरचना समझाइये। (UP BTE 2013, 14)
Explain the atomic structure of ammonia and water according to VSEPR theory.
अथवा
समझाइए कि H2O का बन्ध कोण, NHS के बन्ध कोण से कम क्यों होता है? (UP BTE 2015)
Explain why H2O bond angle is less than NH3 bond angle?
उत्तर – अमोनिया (NH3) अणु की आकृति NH3 के अणु में तीन संकरित कक्षक बन्ध बनाने में प्रयुक्त होते हैं तथा इनमें साझे के इलेक्ट्रॉन युग्म होते हैं, जबकि चौथे संकरित कक्षक में एकाकी इलेक्ट्रॉन युग्म होता है। ऐसी स्थिति में बन्ध कोण 109° 28′ से घटकर 106° 45′ हो जाता है, क्योंकि एकाकी इलेक्ट्रॉन युग्म तथा बन्ध इलेक्ट्रॉन युग्म के बीच प्रतिकर्षण दो बन्ध इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण से अधिक होता है। बन्ध कोण के घटने के कारण ही NH3 का आकार पिरामिड जैसा हो जाता है।
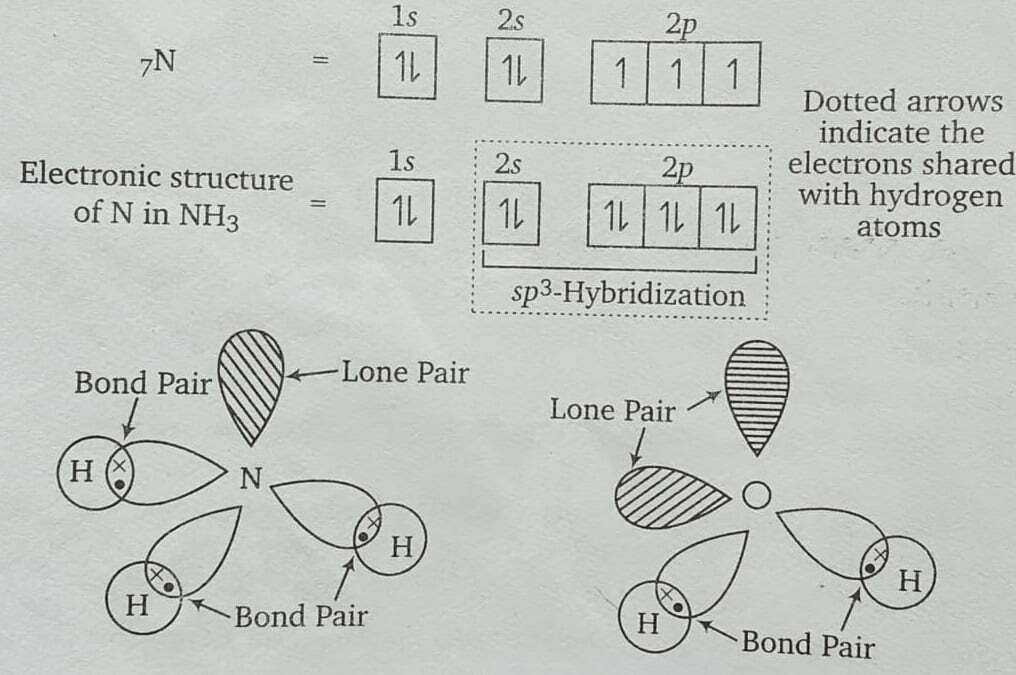
जल (H2O) अणु की आकृति H20 के अणु में दो संकरित कक्षक बन्ध बनाने में प्रयुक्त होते हैं तथा इनमें साझे के इलेक्ट्रॉन होते हैं, जबकि शेष दो संकरित कक्षकों में एकाकी इलेक्ट्रॉन युग्म होते हैं। ऐसी स्थिति में बन्ध कोण और भी घटकर 104° 27′ हो जाता है; क्योंकि दो एकाकी इलेक्ट्रॉन युग्म एक-दूसरे को और अधिक प्रतिकर्षित करते हैं तथा दोनों O—H बन्ध इलेक्ट्रॉन युग्मों को और पास ले आते हैं। बन्ध कोण की इसी कमी के कारण ही H20 का आकार V-आकार का हो जाता है।
चूँकि NH3 अणु की आकृति चतुष्फलकीय न होकर पिरामिड जैसी होती है जिससे इसका बन्ध कोण 106°45′ हो जाता है तथा H20अणु की आकृति चतुष्फलकीय न होकर V आकार की होती है जिससे इसका बन्ध कोण 104°27′ हो जाता है। इसलिए H2O का बन्ध कोण, NH3 के बन्ध कोण से कम होता है।
प्रश्न 12- N2 का आण्विक कक्षक विन्यास प्रदर्शित कीजिए। इसके आबन्ध कोटि (bond order) व चुम्बकीय व्यवहार बताइये। (UPBTE 2013)
Represent atomic orbital configuration of N2. Mention its bond order and magnetic behaviour.
उत्तर N2 अणु के कक्षक विन्यास के लिए प्रश्न संख्या 6 का उत्तर देखिए।
N2 अणु नाइट्रोजन परमाणु का इलेक्ट्रॉनिक विन्यास 1s2, 2s2, 2p1x, 2p1y, 2p1z होता है। चूंकि नाइट्रोजन अणु की संरचना में 1s कक्षक (K कोश) के इलेक्ट्रॉन भाग नहीं लेते, अत: प्रत्येक नाइट्रोजन के पाँच-पाँच इलेक्ट्रॉन अर्थात् दस इलेक्ट्रॉन विभिन्न अणु कक्षकों में वितरित करने होते हैं, जिसे निम्न प्रकार से दर्शाया गया है
N₂ : KK (σ2s)² (σ * 2s)² (π 2pᵧ)² (π2pz )² (σ2px )² स्पष्ट है कि इस स्थिति में, आबन्धी इलेक्ट्रॉनों की संख्या =2 + 2 + 4= 8
आबन्धी कोटि=(8-2)/2=3
प्रति आबन्धी इलेक्ट्रॉनों की संख्या = 2;
चूँकि N2 अणु में कोई अयुग्मित (unpaired) इलेक्ट्रॉन नहीं है; अत: N2 अणु प्रतिचुम्बकीय है।
प्रश्न 13- सिग्मा बन्ध व पाई बन्ध में अन्तर स्पष्ट कीजिए। (UPBTE 2013)
Differentiate between sigma bond and pie bond
उत्तर- सिग्मा (σ) व पाई (π) बन्ध में अन्तर
| सिग्मा बन्ध (σ) Sigma bond | पाई बन्ध (π) Pie bond |
| 1 .यह बन्ध s-s, s-p या p-p कक्षकों के एक अक्ष पर उनके सिरों द्वारा अतिव्यापन से बनता है। | 1. यह बन्ध p-p के आंशिक अतिव्यापन से बनता है। |
| 2.अतिव्यापन अधिकतम होने के कारण बन्ध प्रबल होता है। | 2. अतिव्यापन आंशिक होने के कारण बन्ध दुर्बल होता है। |
| 3. यह कम क्रियाशील होता है। | 3. यह अधिक क्रियाशील होता है। |
| 4. दो परमाणुओं के बीच केवल एक σ-बन्ध होता है। | 4. दो परमाणुओं के बीच एक से अधिक π-बन्ध हो सकते हैं। |
| 5. इस बन्ध का इलेक्ट्रॉन मेघ आण्विक अक्ष पर सममित होता है | 5. इस बन्ध का इलेक्ट्रॉन मेघ आण्विक अक्ष पर असममित होता है |
| 6. σ -बन्ध के चारों ओर परमाणुओं का मुक्त घूर्णन सम्भव है। | 6. π-बन्ध के चारों ओर परमाणुओं का मुक्त घूर्णन सम्भव नहीं है |
| 7. यह बन्ध स्वतन्त्र रूप से दो परमाणुओं के बीच बन सकता है अर्थात् इसके बनने के लिये अणु में पहले से π-बन्ध की उपस्थिति आवश्यक नहीं होती है | 7. यह बन्ध तब बनता है जब दो परमाणुओं के बीच σ -बन्ध पहले से उपस्थित हो। |
| 8. इन बन्धों के द्वारा अणुओं की आकृति प्रभावित होती है। | 8. इन बन्धों के द्वारा अणुओं की आकृति प्रभावित नहीं होती है। |
प्रश्न 14. वैद्युत संयोजक, सहसंयोजक एवं उपसहसंयोजक यौगिकों में अन्तर बताइए।
Differentiate between electrovalent, covalent and co-ordinate compound. .
उत्तर वैद्युत संयोजक, सहसंयोजक एवं उपसहसंयोजक यौगिकों में अन्तर
| वैद्युत संयोजक यौगिक | सहसंयोजक यौगिक | उपसहसंयोजक यौगिक |
| 1. ये यौगिक इलेक्ट्रॉन के स्थानान्तरण से बनते हैं। | ये यौगिक इलेक्ट्रॉन की बराबर की साझेदारी से बनते हैं। | इनमें एक परमाणु इलेक्ट्रॉन युग्म दाता और दूसरा इलेक्ट्रॉन युग्म ग्राही होता है। |
| 2. इनमें परमाणु आयन के रूप में रहते हैं। अत: ये विद्युत चालक होते हैं। | ये यौगिक अणु के रूप में रहते हैं और विद्युत चालक नहीं होते हैं। | ये यौगिक भी अणु के रूप में रहते हैं और विद्युत चालक नहीं होते। |
| 3. इनमें ध्रुवीय (polar) बन्ध होता है। | इनमें बन्ध प्रायः अध्रुवीय होता है। | इनमें अर्द्धध्रुवीय (semi-polar) बन्ध होता है। |
| 4. ये यौगिक जल में विलेय, परन्तु कार्बनिक विलायकों में अविलेय होते हैं। हैं। | ये यौगिक जल में अविलेय, परन्तु कार्बनिक विलायकों में विलेय होते | ये यौगिक जल में अविलेय, परन्तु कार्बनिक विलायकों में विलेय होते हैं। |
| 5. इन यौगिकों के गलनांक तथा क्वथनांक उच्च होते हैं; क्योंकि ये शीघ्र वाष्पित नहीं होते। | इन यौगिकों के गलनांक तथा क्वथनांक कम होते हैं; क्योंकि ये वाष्पशील होते हैं। | इनके गलनांक तथा क्वथनांक विद्युत संयोजक यौगिकों से कम तथा सहसंयोजक यौगिकों से अधिक होते हैं। |
प्रश्न 15- मेथेन (CH4 ) तथा जल (H2O) का निर्माण कैसे होता है? समझाइए।
How can be methane(CH4) and water (H2O) formed? Explain.
उत्तर- मेथेन, CH4 अणु का निर्माण कार्बन का सामान्य अवस्था में इलेक्ट्रॉनिक विन्यास 1s2, 2s2, 2p1x, 2p1y, है। इसमें दो अर्द्धपूर्ण p-कक्षक हैं जो यह प्रदर्शित करते हैं कि कार्बन एक द्विसंयोजी परमाणु है, परन्तु यह वास्तव में एक चतु:संयोजी (tetravalent) तत्त्व है। यह समझाने के लिए कि कार्बन परमाणु की संयोजकता चार है, यह माना गया है कि 2s कक्षक से 1 इलेक्ट्रॉन कूदकर खाली 2pz, कक्षक में चला जाता है। इससे कार्बन परमाणु का उत्तेजित अवस्था (excited state) में इलेक्ट्रॉनिक विन्यास 1s2, 2s2, 2p1x, 2p1y, 2p1z हो जाता है।

मेथेन अणु के बनने में कार्बन के चार अर्द्धपूर्ण कक्षक चार हाइड्रोजन के 1s कक्षकों के साथ संयोग कर एक s-s तथा तीन s-pबन्ध बनायेंगे, परन्तु ये चारों C-H बन्ध समान हैं। इसे समझाने के लिए यह कल्पना की गयी है कि बन्ध निर्माण के समय कार्बन के चारों अर्द्धपूर्ण कक्षक परस्पर मिलकर संकरण (hybridization) में भाग लेते हैं और समान ऊर्जा के चार sp3 -कक्षक बनाते हैं।
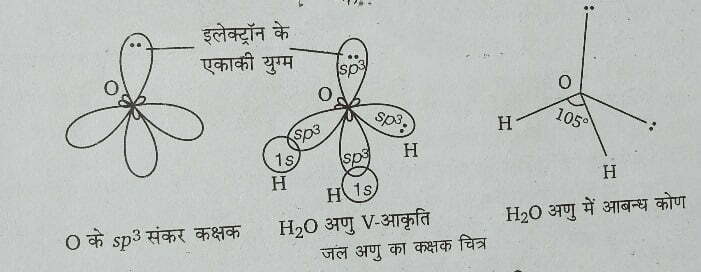
अब ये चार समान ऊर्जा वाले sp3 कक्षक चार हाइड्रोजन परमाणुओं के 1s कक्षकों के साथ अतिव्यापन कर मेथेन अणु का निर्माण करते हैं। संकरण द्वारा निर्मित अणु चतुष्फलकीय (tetrahedral) आकृति का होता है, जिसमें H-C-H आबन्ध कोण (bond angle) 109°28′ होता है। जल, H20 अणु का निर्माण ऑक्सीजन का इलेक्ट्रॉनिक विन्यास 1s2, 2s2, 2p2x, 2p1y, 2p1z होता है।
इसके दो अर्द्धपूर्ण p-कक्षक दो हाइड्रोजन परमाणुओं के 1s-कक्षकों के साथ अतिव्यापन कर दो sp-बन्ध बना सकते हैं जिससे जल अणु की आकृति रेखीय होनी चाहिए, परन्तु वास्तव में जल अणु V आकृतीय होता है। इसे समझाने के लिए कल्पना की गयी है कि ऑक्सीजन का एक 2s तथा तीन 2p कक्षक बन्ध बनाने से पूर्व संकरण में भाग लेकर समान ऊर्जा वाले चार sp3 संकर कक्षक बनाते हैं।
इनमें से दो में इलेक्ट्रॉन के एकाकी युग्म होते हैं और दो sp3 कक्षक दो हाइड्रोजन परमाणुओं के 1s कक्षकों के साथ अतिव्यापन कर दो sp-बन्ध बनाते हैं। इस प्रकार निर्मित जल अणु में इलेक्ट्रॉन के दो एकाकी युग्म अन्य कक्षकों को अधिक दबाते हैं जिससे H-0-H बन्ध कोण घटकर 105° रह जाता है।
प्रश्न16- समझाइए ग्रेफाइट सुचालक क्यों है? (UPBTE 2016)
Explain why graphite is a conductor?
उत्तर- ग्रेफाइट विद्युत का सुचालक होता है; क्योकि इसकी संरचना में प्रत्येक कार्बन परमाणु सह-संयोजक बन्ध (covalent bond) के द्वारा केवल तीन कार्बन परमाणु से जुड़े रहते हैं। अत: कार्बन के चार संयोजक इलेक्ट्रॉन में से केवल तीन इलेक्ट्रॉन बन्ध बनाने हेतु प्रयोग में आते हैं और चौथा इलेक्ट्रॉन मुक्त रहता है। यह मुक्त इलेक्ट्रॉन एक से दूसरे कार्बन परमाणु पर गति कर सकता है। इन्हीं मुक्त इलेक्ट्रॉनों के कारण ग्रेफाइट एक अच्छा सुचालक होता है।
UP Polytechnic Previous year paper Applied Chemistry
Polytechnic Applied Chemistry important Question bank in hindi
UP Polytechnic Previous year paper Applied Chemistry
इसे भी पढ़े…..
- रेती क्या होता है ?
- रेती के भाग (Parts of Files)
- रेती का वर्गीकरण (Classification of File)
- दाँतों का कट (Cut of Teeth)
- ग्रेड (Grade)
- भारतीय मानक के अनुसार फाइल में कट का ग्रेड (Grade of Cut in a File as per I.S.I.)
- स्पेसीफिकेशन ऑफ फाइल (Specification of File)
- कट और ग्रेड में अन्तर (Difference between Cut and Grade)
- फाइलिंग कितनें प्रकार की जाती है (Types of Filing)
- सावधानियाँ (Precautions During to Use The File)

