Polytechnic Applied Chemistry important Question bank in hindi | applied chemistry important questions pdf | applied chemistry paper 2021 | Polytechnic Applied Chemistry important Question bank in hindi | Polytechnic Applied Chemistry important Question bank in hindi | Atomic Structure
Question and Answers
प्रश्न 1. समस्थानिक तथा समभारिक की परिभाषा दीजिए। प्रत्येक के कम-से-कम दो उदाहरण दीजिए।(UP BTE 2002, 03)
Give definition of isotopes and isobars. Give at least two examples of each.
उत्तर – समस्थानिक Isotopes किसी एक ही रासायनिक तत्त्व तथा समान परमाणु संख्या वाले परमाणु जिनकी द्रव्यमान संख्या भिन्न-भिन्न होती है, समस्थानिक (isotopes) कहलाते हैं।
उदाहरणार्थ –
(i) हाइड्रोजन के चार समस्थानिक 1H², 1H3, 1H4 तथा 1H6 हैं।
(ii) कार्बन के तीन समस्थानिक C-12, C-13 तथा C-14 हैं।
(iii) रेडियम के चार समस्थानिक 88Ra 222 88Ra223 ‘ 88Ra 224 तथा 88Ra226 हैं।
समभारिक Isobars ऐसे परमाणु, जिनकी द्रव्यमान संख्या तो समान होती हैं, परन्तु वे भिन्न-भिन्न रासायनिक तत्त्वों के बने होते हैं तथा इनके परमाणु क्रमांक (atomic number) भी भिन्न होते हैं, समभारिक (isobars) कहलाते हैं। समभारिक की प्रोटॉन तथा न्यूट्रॉन संख्या भी भिन्न होती है।
उदाहरणार्थ-
(i) 24Cr54 तथा 26 Fe54
(ii) 1H3 तथा 2He3
(iii) 18CI40 तथा 20Ca40
(iv) 82Bi214 तथा 84Po214
प्रश्न 2. हाइजेनबर्ग के अनिश्चितता सिद्धान्त का कथन देकर व्याख्या कीजिए। परमाणुओं के अन्दर और बोर की कक्षाओं की हमारी अवधारणा को यह सिद्धान्त कैसे बदलता है? (UP BTE 2009)
Explain Heisenberg’s Uncertainly Principle with its statement. How this principle can change our consideration for number of electrons in atoms and Bohr’s orbit?
उत्तर- द्रव्य के द्वैत व्यवहार के फलस्वरूप जर्मन वैज्ञानिक वर्नर हाइजेनबर्ग ने सन् 1927 में छोटे कणों की स्थिति तथा उनके संवेग के एक साथ मापनं से सम्बन्धित अनिश्चितता का सिद्धान्त दिया। इस सिद्धान्त को हाइजेनबर्ग का अनिश्चितता का सिद्धान्त कहते हैं। इसके अनुसार-किसी छोटे कण की स्थिति और संवेग दोनों का एकसाथ यथार्थ निर्धारण असम्भव है।
उन्होंने यह भी बताया कि यदि हम किसी कण के संवेग या स्थिति में किसी एक को अधिक यथार्थता से मापते हैं तो दूसरे की यथार्थता कम जाती है। किसी कण की स्थिति में अनिश्चितता तथा उनके संवेग में अनिश्चितता का गुणनफल सदैव एक स्थिरांक होता है तथा इसका मान h/4π या उससे अधिक होता है। गणितीय रूप में इसे निम्नवत् लिखते हैं
∆x.∆p ≥ h/4π …………….(i)
जहाँ, ∆x = स्थिति में अनिश्चितता, ∆p = संवेग में अनिश्चितता, h = प्लांक नियतांक
यहाँ, ∆p = m∆v
यहाँ , m = कण का द्रव्यमान तथा ∆v = वेग अनिश्चितता,
समीकरण (i) को हम निम्नवत् भी लिख सकते हैं
∆x.m∆v ≥ h/4π
∆x.∆v ≥ h/4πm …………..(ii)
अत: समीकरण (ii) दर्शाती है कि किसी कण की सही स्थिति तथा वेग दोनों को जानना असम्भव है। यदि कण की स्थिति का ज्ञान अधिक यथार्थता से किया जाता है तो वेग की अनिश्चितता बहुत अधिक होगी। यही स्थिति सही वेग जानने पर होगी। इस प्रकार बोर का परमाणु प्रतिरूप हाइजेनबर्ग के विरुद्ध है; क्योंकि इन परमाणु प्रतिरूपों में इलेक्ट्रॉनों के वेग तथा स्थिति दोनों का ही एकसाथ बिल्कुल ठीक-ठीक निर्धारण किया गया है। स्पष्ट है कि बोर की अवधारणा हाइजेनबर्ग के नियम से तुलना करने पर विफल हो जाती है, अर्थात् बोर की धारणा कि इलेक्ट्रॉन निश्चित वेग या ऊर्जा से कक्षा में संचलन करता है, सही नहीं है।
इस प्रकार हाइजेनबर्ग का अनिश्चितता का सिद्धान्त, परमाणुओं के अन्दर इलेक्ट्रॉनों और बोर की कक्षाओं की हमारी अवधारणा को बदलता है।
प्रश्न 3. डी-ब्रॉग्ली सिद्धान्त क्या है? परमाणु संरचना समझाने में यह कैसे सहायक है? (UP BTE 2004,06)
What is de-Broglie Principle? How it is useful to understand atomic structure?
उत्तर- 1923 में लुई डी-ब्रॉग्ली (Louis de-Broglie) ने प्रतिपादित किया कि विकिरण के समान ही द्रव्य भी द्वैत व्यवहार प्रदर्शित करता है अर्थात् इसके भी संवेग (momentum) एवं तरंगदैर्घ्य (wavelength) होने चाहिए। उनके अनुसार सभी गतिशील वस्तुओं में तरंग के लक्षण होते हैं, परन्तु इनकी तरंगदैर्घ्य (अधिक द्रव्यमान होने के कारण) इतनी कम होती है कि इनके तरंग जैसे गुणों का पता ही नहीं चल पाता। इलेक्ट्रॉन तरंग के गुण प्रदर्शित करता है। अधिक द्रव्यमान के कण प्रोटॉन आदि भी तरंग गुण प्रदर्शित करते हैं, परन्तु उन कणों के लिए 2 का मान कम होने के कारण उनकी तरंगों के रूप में पहचान करना सम्भव नहीं है।
यदि इलेक्ट्रॉन तरंग के गुण दर्शाता है तो उसकी ऊर्जा,
E = hv ………….(i)
जहाँ h = प्लांक स्थिरांक तथा v = आवृत्ति यदि इलेक्ट्रॉन कण के गुण दर्शाता है तो उसकी ऊर्जा
E = mc2 (आइन्स्टीन समीकरण) …….(ii)
समीकरण (i) तथा (ii) से,
hv = mc2 ..(iii)
h c/λ = mc² (v=c/λ)………..(i)
λ= h/mc
इलेक्ट्रॉन हेतु c प्रकाश का वेग है, जबकि अन्य द्रव्यों (जो तरंग तथा कण दोनों के समान व्यवहार करते हैं) के लिए c = v (उनका वेग) तथा m = उनका द्रव्यमान
λ=h/mv
उपर्युक्त समीकरण को डी-ब्रॉग्ली ने दिया तथा इसे डी-ब्रॉग्ली समीकरण (de-Broglie equation) कहते हैं। इस समीकरण के λ को डी-ब्रॉग्ली तरंगदैर्घ्य (de-Broglie wavelength) कहते हैं।
अब, mv = p (संवेग)
λ=h/p …(iv)
अतः समीकरण (iv) डी-ब्रॉग्ली की समीकरण होती है।
डी-ब्रॉग्ली समीकरण से निम्नलिखित सूचनाएँ प्राप्त होती हैं
1. जितना भारी कण होता है, उतनी ही कम तरंगदैर्घ्य होती है अर्थात्
λ proportional 1/m
2. कण की तरंगदैर्घ्य कण पर आवेश के प्रति स्वतन्त्र होती है।
3. तरंगदैर्घ्य स्पष्ट रूप से कण के साथ, संवेग के प्रतिलोमानुपाती होती है अर्थात्
λ proportional 1/mv proportional 1/p
इस प्रकार डी-ब्रॉग्ली सिद्धान्त परमाणु की संरचना को समझाने में सहायक होता है।
प्रश्न 4. क्वाण्टम संख्याएँ क्या हैं? ये कितने प्रकार की होती हैं? इनमें से प्रत्येक को संक्षेप में समझाइए।
What are quantum numbers? How many types of it are there? Explain each in detail.
अथवा
क्वाण्टम संख्या को परिभाषित कीजिए। Define the quantum number.
अथवा
क्वाण्टम संख्या की व्याख्य कीजिए। 3p कक्षक के इलेक्ट्रॉन के लिए उपयुक्त L तथा M का मान लिखिए।
Explain quantum number. Give suitable L and M value for 3p orbit electron. (UP BTE 2015 ,16)
उत्तर – क्वाण्टम संख्याएँ जिन संख्याओं का प्रयोग करके हम परमाणु में इलेक्ट्रॉनों की ऊर्जा तथा स्थिति (नाभिक से दूरी, कक्षक की आकृति, अभिविन्यास तथा चक्रण की दिशा) से सम्बन्धित समस्त जानकारी प्राप्त कर सकते हैं, उन्हें क्वाण्टम संख्याएँ कहते हैं। क्वाण्टम संख्याएँ निम्नलिखित चार प्रकार की होती हैं
(i) मुख्य क्वाण्टम संख्या Principal Quantum Number यह क्वाण्टम संख्या उस कक्ष को प्रदर्शित करती है जिसमें इलेक्ट्रॉन होता है। इसे मुख्य ऊर्जा स्तर (principal energy level) भी कहते हैं। अतः इस क्वाण्टम संख्या से कक्ष में उपस्थित इलेक्ट्रॉन की केन्द्रक से दूरी तथा उसकी ऊर्जा का ज्ञान होता है। इसे n द्वारा व्यक्त करते हैं। n का मान शून्य को छोड़कर 1, 2, 3, 4 आदि पूर्णांक होता है जो क्रमश: K, L, M, N आदि कक्ष प्रदर्शित करते हैं। जितनी अधिक क्वाण्टम संख्या होती है, उतनी ही अधिक इलेक्ट्रॉन की ऊर्जा होती है। किसी मुख्य ऊर्जा स्तर में इलेक्ट्रॉन की अधिकतम संख्या 2n2 होती है।
(ii) दिगंशी, द्वितीयक या ऑर्बिटल क्वाण्टम संख्या Azimuthal, Secondaryor Orbital Quantum Number एक ही मुख्य क्वाण्टम संख्या वाले विभिन्न इलेक्ट्रॉन पूर्णतया समान ऊर्जा नहीं रखते और एक ही ऑर्बिटल में नहीं रहते; क्योंकि किसी मुख्य ऊर्जा स्तर में ऊर्जा के विभिन्न उपस्तर (sub-levels) होते हैं। यह क्वाण्टम संख्या जो उस ऊर्जा उप-स्तर को प्रदर्शित करता है जिसमें इलेक्ट्रॉन रहता है और कक्षक की आकृति तथा इलेक्ट्रॉन के कोणीय संवेग की ऊर्जा को निर्धारित करता है, दिगंशी क्वाण्टम संख्या कहलाती है। इसे । द्वारा प्रदर्शित करते हैं। 1 के मान शून्य से n-1 तक सभी पूर्णांक होते हैं। उदाहरणार्थ
यदि n = 1 तो l = 0 (1s कक्षक)
n = 2 तो l = 0,1 (25,2p कक्षक)
n = 3 तो l = 0, 1, 2 (35,3p, 3d कक्षक)
n = 4 तो l = 0, 1, 2, 3 (4s, 4p, 4d, 4f कक्षक)
l का मान 0, 1, 2 तथा 3 होने पर कक्षकों के नाम क्रमशः s, p, d तथा f होते हैं। अत: जब n = 4 तथा l = 3 हो तो
इलेक्ट्रॉन 4f उपस्तर (कक्षक) में होगा।
ii) चुम्बकीय क्वाण्टम संख्या Magnetic Quantum Number यह संख्या कक्षक का अन्तरिक्ष में अभिविन्यास (orientation in space) प्रदर्शित करती है। इसे m द्वारा व्यक्त करते हैं। m का मान । के मान पर निर्भर करता है जो -1 से 0 होकर +1 तक होता है। इस प्रकार m के कुल मान (2l +1) होते हैं।
कक्षकों की कुल संख्या (2l + 1)
उदाहरणार्थ- l = 0 तो m =0 (एक s कक्षक)
l = 1 तो m = -1, 0, + 1, (तीन p कक्षक)
l= 2 तो m = -2,- 1, 0, +1, +2 (पाँच d कक्षक)
l = 3 तो m = – 3, – 2, – 1, 0, + 1, + 2, + 3 (सात f कक्षक)
अतः s उपस्तर (उपकोश sub-level) में एक कक्षक होता है और p, d तथा f उपस्तरों में क्रमश: 3, 5 तथा 7 कक्षक होते हैं।
(iv) स्पिन क्वाण्टम संख्या Spin Quantum Number इलेक्ट्रॉन केन्द्रक के चारों ओर घूमते समय अपनी स्वयं की अक्ष (axis) पर चक्रण (spin) करता है। इलेक्ट्रॉन के भ्रमण की दिशा को दर्शाने वाली क्वाण्टम संख्या को स्पिन क्वाण्टम संख्या कहते हैं। इसे s द्वारा प्रदर्शित करते हैं। s के दो मान + 1 तथा -होते हैं; क्योंकि इलेक्ट्रॉन के स्पिन
करने की दो दिशायें सम्भव हैं।
1 दक्षिणावर्त (clockwise) दिशा को + 1/2 या Up द्वारा और वामावर्त (anti-clockwise) दिशा को -1/2 या down द्वारा प्रदर्शित करते हैं।
इस प्रकार ये चारों क्वाण्टम संख्याएँ हमें मुख्य ऊर्जा या कोश (n), उपस्तर (), कक्षक का अभिविन्यास (orientation) अर्थात् कक्षक में इलेक्ट्रॉन की स्थिति (m) तथा स्पिन की दिशा (s) बताती हैं। विभिन्न क्वाण्टम संख्या और उनके इलेक्ट्रॉनों को तालिका के रूप में निम्न प्रकार स्पष्ट किया जा सकता है
प्रश्न 5. कक्षक की परिभाषा दीजिए। s,p तथा d कक्षकों की आकृति खींचिए।
Give definition of orbital. Draw structure of s, p and d orbital.
उत्तर — कक्षक Orbital केन्द्रक के बाहर का वह भाग जिसमें इलेक्ट्रॉन के पाये जाने की अधिकतम सम्भावना होती है, कक्षक (orbital) कहलाता है। कक्षक चार प्रकार के होते हैं। ये s, p, d तथा f द्वारा प्रदर्शित किये जाते हैं। ये नाम स्पेक्ट्रम के आधार पर क्रमशः तीक्ष्ण (sharp), मुख्य (principal), विसरित (diffuse) तथा मूल (fundamental) से लिये गये हैं। किसी एक कक्षक में अधिकतम दो इलेक्ट्रॉन हो सकते हैं। अत: s, p, d तथा f कक्षकों में क्रमश: 2,6, 10 तथा 14 इलेक्ट्रॉन तक हो सकते .
अत: स्पष्ट है कि पहले कक्ष (n = 1) में केवल एक (12) कक्षक होता है जिसे ऽ-कक्षक कहते हैं। दूसरे कक्ष (n = 2) में चार (22) कक्षक होते हैं जिनमें एक s या तीन p-कक्षक होते हैं। तीसरे कक्ष (n = 3) में नौ (32) कक्षक होते हैं जिनमें एक तीन p तथा पाँच d-कक्षक होते हैं। चौथे कक्ष (n = 4) में सोलह (42) कक्षक होते हैं जिनमें एक s, तीन p, पाँच d तथा सात f-कक्षक होते हैं।
कक्षकों की आकृतियाँ Shapes of orbitals
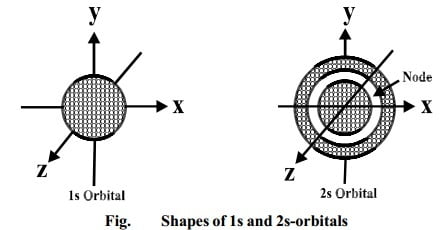
कक्षक निश्चित आकार के होते हैं। s-कक्षक (s-orbital) की आकृति परमाणु केन्द्रक के बाहरी ओर गोलाकार (spherical) होती है। (संलग्न चित्र के अनुसार)
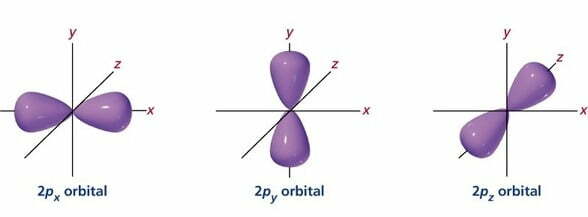
तीनों p-कक्षक डमरू (डम्बेल-dumb-bell) की आकृति के होते हैं। इनमें प्रत्येक अक्ष रेखा (axis) दूसरे दो कक्षकों की अक्ष रेखाओं (axes) पर लम्ब (perpendicular) होती है। तीनों p-कक्षकों में अन्तर स्थापित करने के लिये इन्हें Pr, P, तथा p, नामों से पुकारते हैं, जबकि x,y तथा : सम्बन्धित अक्ष प्रदर्शित करते हैं।
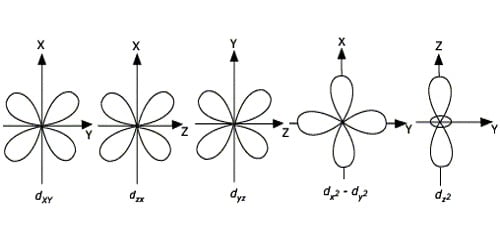
d-कक्षकों की आकृतियाँ जटिल (complicated) होती हैं। d-ऑर्बिटल द्वि-डम्बेल (double dumb-bell) आकृति के होते हैं।
प्रश्न 6. कक्ष ( orbit ) तथा कक्षक ( orbital ) में अन्तर स्पष्ट कीजिए।
Differentiate between orbit and orbital.
उत्तर- कक्ष तथा कक्षक में अन्तर
| कक्ष ( orbit ) | कक्षक ( orbital ) |
| 1. यह परमाणु के नाभिक (केन्द्रक) के चारों ओर एक चक्रीय पथ होता है जिस पर इलेक्ट्रॉन भ्रमण करते हैं। | 1 – यह परमाणु के नाभिक के बाहर का वह भाग होता है जिसमें इलेक्ट्रॉनों के पाये जाने की अधिकतम सम्भावना होती है। |
| 2.ये आकृति में चक्रीय (circular) होते हैं। | 2 – इनकी विभिन्न आकृतियाँ होती हैं; जैसे- sकक्षक गोलाकार तथा p कक्षक डुगडुगी आकार के होते हैं। |
| 3. यह इलेक्ट्रॉन का भ्रमण केन्द्रक के चारों ओर एक ही तल (plane) में प्रदर्शित करता है। | 3- यह इलेक्ट्रॉन का भ्रमण केन्द्रक के चारों ओर तीन दिशाओंx, y तथा z-अक्षों के साथ प्रदर्शित करता है। |
| 4. किसी कक्ष में इलेक्ट्रॉन की अधिकतम संख्या 2n होती है, जबकि n कक्ष का क्रमांक होता है। अतः पहले, दूसरे, तीसरे तथा चौथे कक्ष में अधिकतम इलेक्ट्रॉन क्रमशः 2, 8, 18 तथा 32 हो सकते हैं। | 4- पाउली के अपवर्जन के सिद्धान्तानुसार किसी कक्षक में इलेक्ट्रॉन की अधिकतम संख्या 2 होती है जिनके स्पिन विपरीत होते हैं |
प्रश्न 7. पाउली ( Pauli’s ) का अपवर्जन का नियम लिखिए।
Write Pauli’s exclusion Law.
उत्तर – सन् 1925 में पाउली ने एक नियम प्रतिपादित किया जिसके अनुसार-“किसी भी परमाणु में किन्हीं दो इलेक्ट्रॉनों की चारों क्वाण्टम संख्याएँ समान नहीं हो सकतीं।
उदाहरणार्थ – 2He4
इलेक्ट्रॉनिक विन्यास = 1s2
1st इलेक्ट्रॉन के लिए
n = 1, l = 0, m = 0, s = +1/2
2nd इलेक्ट्रॉन के लिए
n = 1, l = 0, m = 0, s = -1/2
अत: किन्हीं भी दो इलेक्ट्रॉनों के लिए चारों क्वाण्टम संख्याओं के मान बराबर नहीं हो सकते।
प्रश्न 8. हुण्ड के नियम का उल्लेख कीजिए। एक उदाहरण देकर इसे स्पष्ट कीजिए। ।
Mention Hund’s rule and explain it by giving an example.
उत्तर – हुण्ड के नियम के अनुसार, “किसी उपकोश के कक्षक में इलेक्ट्रॉन तभी युग्मित होते हैं जब उस उपकोश के सभी कक्षकों में एक-एक इलेक्ट्रॉन भर जाता है। इलेक्ट्रॉन जब युग्मित होते हैं तो युग्म के दोनों इलेक्ट्रॉन विपरीत चक्रण वाले होते हैं।”
इस नियम के अनुसार, s-कक्षक में दूसरे इलेक्ट्रॉन के प्रवेश पर, p-कक्षक में चौथे इलेक्ट्रॉन के प्रवेश पर, d-कक्षक में छठे इलेक्ट्रॉन के प्रवेश पर तथा f-कक्षक में आठवें इलेक्ट्रॉन के प्रवेश पर युग्मन आरम्भ होता है।
उदाहरणार्थ-नाइट्रोजन परमाणु में p-उपकोश में तीनों इलेक्ट्रॉन अलग-अलग p-कक्षकों अर्थात् px, py, और pz. में रहते हैं। ये इलेक्ट्रॉन अयुग्मित तथा समदिश चक्रण वाले होते हैं। इस परमाणु में इलेक्ट्रॉन वितरण इस प्रकार होता है
प्रश्न 9. एक तत्त्व (परमाणु क्रमांक = 21) के अन्तिम डाले गये इलेक्ट्रॉन के लिए चारों क्वाण्टम संख्याओं के मान ज्ञात कीजिए।
Find the four quantum number value for inserted late electron in an element (atomic no. = 21).
अथवा
3d1 इलेक्ट्रॉन के लिए n,l,m व s क्वाण्टम संख्याओं के मान लिखिए।
Write n, l, m, s quantum number values for 3dl electron.
उत्तर – परमाणु क्रमांक 21 के तत्त्व का इलेक्ट्रॉनिक विन्यास इस प्रकार होगा
1s2, 2s2 , 2p6, 3s2, 3p6, 4s2, 3d1
तत्त्व के परमाणु ऑर्बिटलों का भराव होने में अन्तिम डाला गया इलेक्ट्रॉन (21वाँ इलेक्ट्रॉन) 3d ऑर्बिटल में जायेगा; क्योंकि 3d ऑर्बिटल की ऊर्जा 4s ऑर्बिटल से अधिक होती है।
अत: 21वें इलेक्ट्रॉन (3d1 इलेक्ट्रॉन) के लिए
n = 3, l = 2, m = – 2, s = +1/2
प्रश्न 10. समस्थानिक तथा समभारिक में अन्तर स्पष्ट कीजिए।
Differentiate between isotopes and isobars
उत्तर- समस्थानिक तथा समभारिक में अन्तर क्र.सं. समस्थानिक (Isotopes)
| समस्थानिक ( isotopes ) | समभारिक ( isobars ) |
| 1. समस्थानिक एक ही तत्त्व के वे विभिन्न परमाणु होते हैं जिनके परमाणु भार भिन्न, परन्तु परमाणु संख्या समान होती हैं | 1. समभारिक विभिन्न तत्त्वों के वे परमाणु होते हैं जिनके परमाणु भार समान, परन्तु परमाणु संख्या भिन्न होती हैं। |
| 2. इनके केन्द्रकों में प्रोटॉन तथा न्यूट्रॉन का योग भिन्न होता है और परमाणु केन्द्रकों का संगठन भी भिन्न होता है | 2. इनके केन्द्रकों में प्रोटॉन तथा न्यूट्रॉन का योग समान होता है,परन्तु उनके केन्द्रकों के संगठन भिन्न होते हैं। |
| 3. इनमें न्यूट्रॉन की संख्या भिन्न होती है | 3. इनमें इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन की संख्याएँ भिन्न होती हैं। |
| 4. इनमें परमाणु संख्या समान होने के कारण इनकी इलेक्ट्रॉनिक व्यवस्था समान होती है। | 4. इनकी परमाणु संख्या भिन्न होने के कारण इनकी इलेक्ट्रॉनिक व्यवस्था भी भिन्न होती है। |
| 5. इनके रासायनिक गुण समान होते हैं। | 5. इनके रासायनिक गुण भिन्न होते हैं। |
| 6. समान परमाणु संख्या के आधार पर इन्हें आवर्त तालिका में एक ही स्थान पर रखा गया है | 6. परमाणु संख्याओं में भिन्नता के कारण इन्हें आवर्त तालिका में विभिन्न स्थानों पर रखा गया है। |
प्रश्न 11. हाइड्रोजन के उत्सर्जन स्पेक्ट्रम का वर्णन कीजिए।
Explain emission spectrum of Hydrogen.
उत्तर – हाइड्रोजन के उत्सर्जन स्पेक्ट्रम में काफी संख्या में रेखाएँ होती हैं। प्रत्येक रेखा हाइड्रोजन परमाणुओं द्वारा उत्सर्जित प्रकाश की निश्चित आवृत्ति के संगत होती है। ये रेखाएँ पराबैंगनी, दृश्य तथा अवरक्त क्षेत्र में होती हैं। पराबैंगनी और दृश्य क्षेत्र की रेखाओं को सीधे फोटोग्राफिक फिल्म पर प्राप्त किया जा सकता है, परन्तु अवरक्त क्षेत्र की रेखाओं का पता दूसरी विधियों द्वारा लगाया जाता है।
इस स्पेक्ट्रम में रेखाएँ पाँच समूहों में होती हैं, जिन्हें, श्रेणियाँ (series) कहते हैं। ये पाँच श्रेणियाँ हैं लाइमन (Lymen), बामर (Balmer), पाश्चन (Paschen), ब्रैकेट (Bracket) तथा फुण्ड (Pfund)। श्रेणियों के ये नाम उनका अध्ययन करने वाले वैज्ञानिकों के नाम पर हैं। लाइमन श्रेणी, पराबैंगनी क्षेत्र, बामर श्रेणी दृश्य क्षेत्र और शेष तीनों श्रेणियाँ अवरक्त क्षेत्र में पड़ती हैं।
प्रश्न 12. उदासीन तत्त्व में K इलेक्ट्रॉन की संख्या 2,L इलेक्ट्रॉन की संख्या 8 तथा M इलेक्ट्रॉन की संख्या 5 है। इस सूचना के आधार पर यथा-सम्भव निम्नलिखित राशियों की पूर्ति कीजिए
In any neutral element, number of electron in Kis 2, number of electrons in L is 8 and number of electrons in M is 5. On the basis of this information fill suitable quantities.
(क) परमाणु भार,
(ख) परमाणु संख्या,
(ग) s-इलेक्ट्रॉनों की कुल संख्या,
(घ) p-इलेक्ट्रॉनों की कुल संख्या,
(ङ) d-इलेक्ट्रॉनों की कुल संख्या,
(च) केन्द्र में न्यूट्रॉनों की संख्या,
(छ) तत्त्व की संयोजकता।
(a) Atomic weight, (b) Atomic number (c) Total no. of electron is s. (d) Total no. of p electron, (e) Total no. of d-electron, (f) No. of neutrons in centre, (g) valency of electron. .
उत्तर – तत्त्व में K इलेक्ट्रॉन 2, L इलेक्ट्रॉन 8 तथा M इलेक्ट्रॉन 5 हैं। अत: कुल इलेक्ट्रॉन संख्या = 2 + 8 + 5 = 15
(क) परमाणु संख्या 15 वाले तत्त्व के केन्द्रक में 15 प्रोटॉन होंगे। अत: न्यूट्रॉन लगभग 15 होंगे। वास्तव में परमाणु संख्या 15 वाला तत्त्व फॉस्फोरस है जिसका परमाणु भार 13 है।
(ख) चूँकि इलेक्ट्रॉन संख्या = प्रोटॉन संख्या = परमाणु संख्या= 15
अतः तत्त्व की परमाणु संख्या = 15
(ग) तत्त्व का वैद्युत् विन्यास 1s2, 2s2 p6, 3s2 3p1 x, 3p1y, 3p1 z होगा।
अत: एक s-इलेक्ट्रॉन की कुल संख्या = 2 + 2 + 2 = 6 है।
(घ) p-इलेक्ट्रॉनों की कुल संख्या = 6 + 3 = 9 है।
(ङ) d-इलेक्ट्रॉनों की कुल संख्या शून्य (zero) है।
(च) न्यूट्रॉनों की संख्या = परमाणु भार – प्रोटॉन संख्या 31-15 = 16
(छ) किसी तत्त्व की संयोजकता उसमें विद्यमान आधे भरे परमाणु कक्षकों के समान होती है। अत: तत्त्व की संयोजकता 3 है।
Polytechnic Applied Chemistry important Question bank in hindi
प्रश्न 13. तीन तत्त्वों का इलेक्ट्रॉनिक विन्यास नीचे दिया गया है। उनके परमाणु भार, परमाणु क्रमांक तथा संयोजकता की गणना कीजिए
Electronic configuration of three elements is given below. Calculate their atomic weight, atomic number and valency.
(i) 1s1
(ii) 1s2, 2s2p6, 3s1
(iii) 1s2, 2s2p6, 3s2p6 ,4s2
उत्तर- (1) तत्त्व का इलेक्ट्रॉनिक विन्यास = 1s1
इस तत्त्व के प्रथम कक्ष के s-कक्षक में केवल 1 इलेक्ट्रॉन है। अत: तत्त्व का परमाणु क्रमांक = इलेक्ट्रॉनों की संख्या 1 और यह तत्त्व हाइड्रोजन है। इस तत्त्व का परमाणु भार 1, परमाणु क्रमांक 1 तथा संयोजकता भी 1 है।
(ii) इलेक्ट्रॉनिक विन्यास = 1s2, 2s2p6, 3s1 है।
इलेक्ट्रॉनों की कुल संख्या = 2 + 2 + 6 + 1 = 11 है।
तत्त्व की परमाणु संख्या = इलेक्ट्रॉनों की संख्या = 11
परमाणु संख्या 11 वाला तत्त्व सोडियम होता है जिसका परमाणु भार 23 होता है। इसके बाह्यतम कक्षक में 1 इलेक्ट्रॉन है। अतः इसकी संयोजकता 1 है।
(iii) इलेक्ट्रॉनिक विन्यास = 1s2, 2s2p6, 3s2p6, 4s2 है।
इलेक्ट्रॉनों की कुल संख्या = 2 + 8 + 8 + 2 = 20
तत्त्व की परमाणु संख्या = इलेक्ट्रॉनों की संख्या = 20
परमाणु संख्या 20 वाला तत्त्व कैल्सियम है जिसका परमाणु भार 40 होता है। इसके बाह्यतम कक्षक में इलेक्ट्रॉन हैं। अत: इसकी संयोजकता 2 है।
प्रश्न 14. नाइट्रोजन, फॉस्फोरस तथा पोटैशियम जिनके परमाणु क्रमांक क्रमशः 7, 15 तथा 19 हैं, के इलेक्ट्रॉनिक विन्यास दीजिए।
Write electronic configuration of nitrozen, phosphorus and potassium. Whose atomic numbers are 7, 15, and 19 respectively.
उत्तर- नाइट्रोजन का परमाणु क्रमांक 7 है। इसका इलेक्ट्रॉनिक विन्यास कक्ष रूप में 2, 5 तथा कक्षक रूप में 1s2, 2s2 2p1x, 2p1z, 2p1z है।
फॉस्फोरस का परमाणु क्रमांक 15 है। इसका इलेक्ट्रॉनिक विन्यास कक्ष रूप में 2, 8, 5 तथा कक्षक रूप में 1s2, 2s2p6, 3s2, 3P1x, 3p1y, 3p1z है।
पोटैशियम का परमाणु क्रमांक 19 है। इसका इलेक्ट्रॉनिक विन्यास कक्ष रूप में 2, 8, 8, 1 तथा कक्षक रूप में
1s2, 2s2p6, 3s2p6,4s1 है।
प्रश्न 15. Mg2+ तथा O2- आयनों की इलेक्ट्रॉनिक व्यवस्था लिखिए।
Write electron arrangement of ions Mg2+ and O2-
उत्तर – किसी तत्त्व या तत्त्वों के समूह को जिस पर विद्युत आवेश हो, आयन (ion) कहते हैं। धन आवेशित आयन को धनायन (cation) और ऋण आवेशित आयन को ऋणायन (anion) कहते हैं।
Mg (परमाणु क्रमांक 12) में से 2 इलेक्ट्रॉन पृथक् होकर Mg2+ बनता है।
Mg – 2e -> Mg2+ (मैग्नीशियम आयन)
अत: Mg2+ में 10 इलेक्ट्रॉन होंगे और इसका इलेक्ट्रॉनिक विन्यास 2, 8 अथवा 1s2, 2s2, 2p3 x, 2p2y, 2p2z होगा। ऑक्सीजन परमाणु (परमाणु क्रमांक 8) 2 इलेक्ट्रॉन ग्रहण कर 02- बनाता है।
0+2e → 02- (ऑक्सीजन आयन)
अत: O2- आयन में 10 इलेक्ट्रॉन होंगे और इसका इलेक्ट्रॉनिक विन्यास 2, 8 अथवा 1s2, 2s2, 2p2x, 2p2y, 2p2z होगा।
Polytechnic Applied Chemistry important Question bank in hindi | Polytechnic Applied Chemistry important Question bank in hindi | Polytechnic Applied Chemistry important Question bank in hindi | Polytechnic Applied Chemistry important Question bank in hindi
इसे भी पढ़े…..
- What is Projection ? How many types of projection 2021
- Drawing Instruments and Conventional Lines
- Workshop & Calculation में पूछे जाने वाले बहुविकल्पिक प्रश्न 2021
- WSC 1st year MCQ Modal Question paper 2021
- Electrician 1st year MCQ in English & Hindi 2021
- ITI 2nd Year Electrician Theory Objective Question 2021
- Diesel MCQ Question and Answer in Hindi 2021
- वेल्डिंग के 100 महत्वपूर्ण प्रश्न उत्तर
